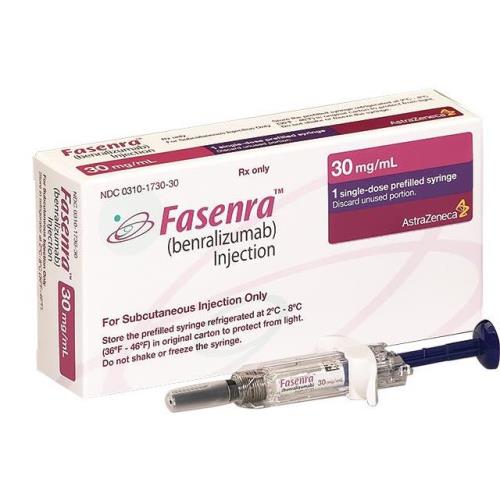
ФАЗЕНРА р-р д/инъекц. п/к 30 мг/мл шприц 1 мл
Состав
| 1 шприц/1 шприц-ручка |
бенрализумаб | 30 мг |
Вспомогательные вещества: L-гистидин - 1.4 мг, L-гистидина гидрохлорида моногидрат - 2.3 мг, ?,?-трегалозы дигидрат - 95 мг, полисорбат 20 (растительного происхождения) - 0.06 мг, вода д/и - приблизительно 910 мг.
Лекарственная форма
Раствор для п/к введения
Описание
Раствор для п/к введения в виде от прозрачной до опалесцирующей, от бесцветной до желтого цвета жидкости.
Действие
Рекомбинантные гуманизированные моноклональные антитела (IgG1). Препарат для лечения бронхиальной астмы Фармакодинамика
Лекарственное средство, применяемое при обструктивных заболеваниях дыхательных путей.
Бенрализумаб представляет собой антиэозинофильное гуманизированное, афукозилированное, моноклональное антитело (IgG1/каппа). Бенрализумаб связывается с альфа-субъединицей рецептора к человеческому интерлейкину-5 (IL-5R?), обладая высоким сродством (16 пМ) и специфичностью. Рецептор к IL-5 находится на поверхности эозинофилов и базофилов. Отсутствие фукозы в Fc домене бенрализумаба облегчает процесс связывания (45.5 нМ) с Fc?RIII-рецепторами на поверхности иммунных эффекторных клеток, таких как натуральные киллеры, что приводит к апоптозу эозинофилов и базофилов посредством антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ).
Эозинофильное воспаление является важным компонентом патогенеза бронхиальной астмы. В эозинофилах содержатся медиаторы воспаления (такие как эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (такие как эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Бенрализумаб, посредством АЗКЦ, уменьшает эозинофильное воспаление.
У большинства пациентов с наличием антител были выявлены нейтрализующие антитела. Наличие антител к бенрализумабу ассоциировалось с повышением клиренса бенрализумаба и повышенным уровнем эозинофилов в крови у пациентов с высокими титрами антител к лекарственному средству в сравнении с пациентами без антител.
Фармакокинетика
После подкожного введения пациентам с бронхиальной астмой период полуабсорбции составлял 3.5 дня. На основании результатов популяционного анализа фармакокинетики расчетная абсолютная биодоступность составила приблизительно 59%, клинически значимые различия в биодоступности при введении в область живота, бедра или плеча не наблюдались. На основании результатов популяционного анализа фармакокинетики центральный и периферический Vd бенрализумаба составил 3.1 л и 2.5 л, соответственно, у пациента с массой тела 70 кг.
Бенрализумаб представляет собой гуманизированное моноклональное антитело класса IgG1. Бенрализумаб расщепляется с участием протеолитических ферментов, которые широко распределены по всему организму человека и не локализованы только в печени. Популяционный анализ фармакокинетики бенрализумаба продемонстрировал, что фармакокинетика препарата носит линейный характер, и его выведение из организма не зависит от связывания с каким-либо рецептором. Рассчитанный системный клиренс бенрализумаба составляет 0.29 л/день у пациента с массой тела 70 кг. После подкожного введения T1/2 составляет приблизительно 15.5 дней.
Показания к применению
Тяжелая бронхиальная астма с эозинофильным фенотипом у взрослых пациентов в качестве дополнительной поддерживающей терапии.
Противопоказания
Детский возраст до 18 лет.
С осторожностью
Беременность и период грудного вскармливания, пациенты с повышенным риском развития гельминтных инвазий.
Применение при беременности и кормлении грудью
Рекомендуется избегать применения лекарственного средства при беременности. Применение при беременности возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода.
Следует оценить пользу грудного вскармливания для здоровья и развития новорожденного, пользу от терапии бенрализумабом для матери и принять решение либо о прекращении грудного вскармливания, либо о приостановлении/прекращении терапии бенрализумабом.
Применение у детей
Применение противопоказано в детском возрасте до 18 лет.
Побочные действия
Со стороны нервной системы: часто - головная боль.
Со стороны иммунной системы: часто - реакции гиперчувствительности.
Инфекции и инвазии: часто - фарингит.
Системные реакции: часто - лихорадка.
Местные реакции: часто - реакции в месте введения.
Взаимодействие
Ферменты семейства цитохрома Р450, эффлюксные насосы и механизмы связывания с белками не вовлечены в клиренс бенрализумаба. Экспрессия IL-5R? на гепатоцитах не была установлена. Снижение количества эозинофилов не сопровождается системным изменением уровня провоспалительных цитокинов.
Способ применения и дозы
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для п/к введения. Лекарственное средство вводят в область плеча, бедра или живота.
Рекомендуемая доза составляет 30 мг. Необходимо вводить один раз в 4 недели (первые 3 инъекции) и затем один раз в 8 недель. Если инъекция пропущена в запланированное время, следует ее выполнить как можно быстрее; двойная доза в связи с пропуском не может быть назначена.
Передозировка
В клинических исследованиях пациенты с эозинофилией получали препарат подкожно в дозах до 200 мг, при этом каких-либо дозозависимых токсических реакций не наблюдалось. Специфическое лечение передозировки бенрализумабом отсутствует. В случае передозировки необходимо проводить поддерживающую терапию и вести наблюдение за состоянием пациента.
Особые указания
Лекарственное средство не предназначено для лечения обострения бронхиальной астмы. Следует информировать пациентов о необходимости обратиться к врачу, если после начала терапии добиться контроля заболевания не удалось, или имеет место ухудшение течения заболевания.
После начала применения не следует резко отменять пероральные ГКС. При необходимости, снижение дозы пероральных ГКС следует производить поэтапно и под наблюдением врача. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии лекарственным средством.
После введения бенрализумаба отмечались реакции гиперчувствительности (такие как анафилаксия, ангионевротический отек, крапивница, папулезная крапивница, кожная сыпь). Эти реакции могут развиваться в течение нескольких часов после введения, однако, в некоторых случаях реакции развиваются позже (спустя несколько дней). При симптомах реакции гиперчувствительности пациенту следует прекратить применение лекарственного средства.
Эозинофилы могут принимать непосредственное участие в развитии иммунологической реакции организма в ответ на паразитарную инвазию. Пациенты с гельминтозами были исключены из клинических исследований. Вероятность изменения реакции организма на гельминтоз при введении бенрализумаба не установлена.
Перед началом применения необходимо провести лечение ранее выявленного гельминтоза. Если паразитарная инвазия развилась на фоне применения лекарственного средства, и пациент не отвечает на применение противогельминтных средств, необходимо прекратить лечение до разрешения паразитарной инвазии.
Влияние на способность к вождению автотранспорта и управлению механизмами
Препарат Фазенра не влияет или оказывает незначительное влияние на способность к управлению транспортными средствами и механизмами.
Форма выпуска
1 мл - шприцы стеклянные (1) с иглой, защитным колпачком для иглы, безопасным устройством введения и вытянутым упором для пальцев - упаковки ячейковые контурные (1) - пачки картонные с контролем первого вскрытия.
1 мл - шприцы стеклянные (1) с иглой и защитным колпачком для иглы, встроенный в шприц-ручку, состоящую из блока привода и блока для шприца - пачки картонные с контролем первого вскрытия.
Условия отпуска из аптек
по рецептуУсловия хранения
При температуре от 2 до 8 °С.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Производитель и организация, принимающие претензии потребителей
Кук Фармика ЛЛС, США
1300 Саут Паттерсон Драйв, Блумингтон, Индиана 47403, США
Cook Pharmica LLC, USA
1300 South Patterson Drive, Bloomington, IN 47403, USA